SOR/98-282法規體系輔導
- 立即咨詢
-
全國服務熱線:
400-888-7587

400-888-7587
? 辦理介紹 / Introduction
? 加拿大《食品和藥品法案》(Food and Drug Act)涵蓋了食品、藥品、化妝品和醫療器械,新的加拿大《醫療器械法規》(Medical Device Regulations(SOR/98-282),簡稱MDR,1988年頒布,2003年1月1日強制實施;MDR的內容包括5個部份及3個附錄;SOR/98-282(簡稱MDR)涵蓋醫療器械的分類、銷售、廣告、基本安全要求、醫療器械標識、注冊許可、進口、產品召回、不良事件報告等方面要求。
? 加拿大實行政府注冊加第三方質量管理體系認證的規管制度;第三方指經加拿大衛生部和加拿大標準委員會(SCC)按照加拿大醫療器械合格評價體系(Canadian Medical Devices Conformity Assessment System,CMDCAS)認可的第三方機構(CMDCAS Registrar)。
? MDR要求:
? II/III/IV類醫療器械制造商必須符合MDR所有有關要求,建立基于ISO13485質量管理體系,并持有CMDCAS Registrar頒發;
? II類醫療器械QMS必須包括制造過程;
? III,IV類醫療器械必須包括設計與制造過程;
? CMDCAS Registrar審核要求:
現場證據除遵循ISO13485標準要求外,還必須滿足加拿大醫療器械法規要求;如
? 風險分析(ISO13485標準7.1;CMDR第10部份);
? 技術文件(ISO13485標準4.2.1 CMDR第10-23部份);
? 制造商分銷/追蹤過程及記錄(ISO13485:2003標識與追溯性 CMDR52-56);
? 適宜的有效過程控制記錄(ISO13485標準 生產批記錄 CMDR 17) ;
? 適宜的滅菌和確認過程(ISO13485標準 特殊過程控制 CMDR 17)
? 制造商的抱怨處理過程(ISO13485標準 客戶投訴處理 CMDR 57,58)
? 制造商強制問題公告和召回過程(ISO13485標準 向監管機構報告 CMDR59-65)
? 搬運/貯存/包裝/防護和交付過程(ISO13485標準 防擴 和CMDR14-15)
? 質量記錄(ISO13485標準 4.2.5 CMDR32 55)
? 可植入性器械的制造商,必須有文件化的規定分銷記錄要求(CMDR66)
? 在審核中,現場證據除遵循ISO 13485標準的質量管理體系外,還須滿足加拿大醫療器械法規要求的程度。如以下:
? 器械制造商評價和相關文件適當的風險分析(ISO 13485和CMDR第10部分)
? 制造商分銷、追蹤過程及記錄(ISO 13485和CMDR 52~56)
? 適宜的有效的過程控制和記錄(ISO 13485和CMDR 32)
?適宜的滅菌和確認過程(ISO 13485/和CMDR第17)
? 制造商抱怨處理過程(ISO 13485和CMDR第57和58)
?制造商強制問題公告和召回過程(ISO 13485和CMDR 59~65)
? 搬運、貯存、包裝、防護和交付過程(ISO 13485和CMDR 14和15)
?質量記錄(ISO 13485和CMDR 32和55)
?可植入器械的制造商(植入物的識別見CMDR模型2),必須有文件化程序規定額外的分銷記錄(CMDR 66部分)。
?目前MDR98/282的最新法規版本為2017,10,25日的內容。
? 辦理流程 / Processing process
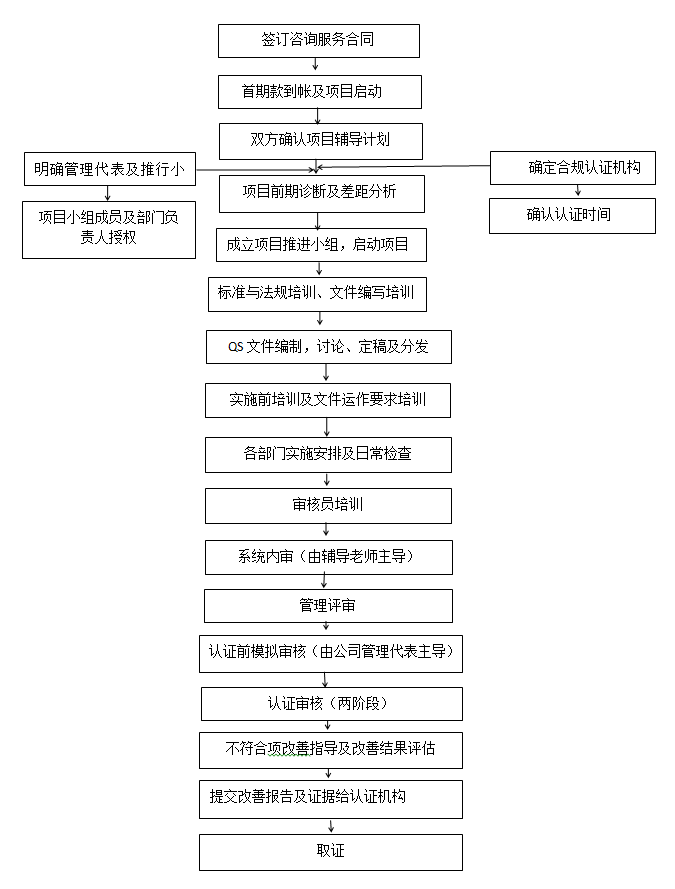
? 金飛鷹項目實施輔導服務 / Golden Eagle related services
●ISO13485:2016、MDR98/282培訓 ●體系推行過程日常監督 ●現場審核陪審 ●體系維持 | ●認證產品依加拿大法規分類 ●內審員培訓及資格證頒發 ●不符合項改善指導及證據審核 | ●體系文件策劃與編制審核、定稿 ●組織內審與管理評審 ●加拿大法規跟蹤 |
全面解決您的研發、生產、驗收、營銷全流程問題

practical experience
2000多個二、三類醫械項目經驗沉淀,為你分配做過相同案例的實戰老師。
Professional translation
匯聚7大語種專業翻譯精英,多年醫械行業翻譯經驗,能準確翻譯專業名詞及用語。
Software development
強大的軟件研發團隊,已為集團研發出成熟的項目管理軟件,可提供軟件定制服務。
Group supply chain
嚴選數十個優秀的醫械行業服務機構,可為客戶推薦更實惠的醫械配套服務。
多次創造二三類高風險產品一次性通過的行業紀錄
項目狀態:已結案
項目輔導老師:李老師
項目狀態:已結案
項目輔導老師:車老師
項目狀態:已結案
項目輔導老師:王老師
項目狀態:已結案
項目輔導老師:黃老師