文章出處:法規動態 網責任編輯: 金飛鷹 閱讀量: 發表時間:2025-07-23
7月21日,上海市藥監局發布《上海市醫療器械生產企業分級監管實施細則》(以下簡稱《實施細則》),《實施細則》適用于對上海市醫療器械生產企業開展的日常監督管理活動,所稱生產企業包括醫療器械注冊人、備案人以及受托生產企業。
我們將《實施細則》正文內容轉載如下:
第一章 總 則
第一條 為加強醫療器械生產監督管理,切實落實監管責任,合理配置監管資源,保障醫療器械安全有效,根據《醫療器械監督管理條例》《醫療器械生產監督管理辦法》《國家藥監局綜合司關于加強醫療器械生產經營分級監管工作的指導意見》等規定,制定本實施細則。
第二條 本實施細則適用于對本市醫療器械生產企業開展的日常監督管理活動,所稱生產企業包括醫療器械注冊人、備案人以及受托生產企業。
第三條 市藥品監管局根據企業獲準上市生產的醫療器械管理類別、產品是否納入重點監管品種目錄、企業生產質量管理體系運行狀況、監管信用記錄等,按照“風險分級、科學監管,全面覆蓋、動態調整,落實責任、提升效能”原則,將企業分為不同監管級別,明確對應監督檢查形式、日常檢查頻次和覆蓋率要求。
第四條 市藥品監管局負責擬制《上海市醫療器械生產重點監管品種目錄》(以下簡稱《市級目錄》),按年度統籌確定本市醫療器械生產企業的監管級別以及對應的監督檢查形式、日常檢查頻次和覆蓋率,統籌日常檢查頻次調整工作,并將當年度確定的監管級別告知企業。本市各級監管部門按職責分工,根據醫療器械生產企業監管級別開展日常監管,并建立運轉順暢的協同監管機制,形成有效監管閉環。
第二章 監管級別的劃分
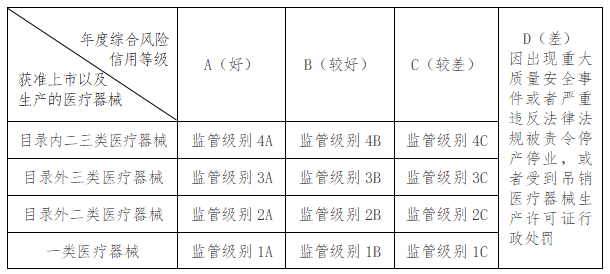
第五條 根據國家《醫療器械生產重點監管品種目錄》(以下簡稱《國家級目錄》)和《市級目錄》,將本市醫療器械生產企業獲準上市以及生產的醫療器械分為四種情形。
(一)一類醫療器械:獲準備案或生產的品種涉及第一類醫療器械;
(二)目錄外二類醫療器械:獲準注冊或者生產的品種涉及除《國家級目錄》或《市級目錄》外其他第二類醫療器械;
(三)目錄外三類醫療器械:獲準注冊或者生產的品種涉及除《國家級目錄》或《市級目錄》外其他第三類醫療器械;
(四)目錄內二三類醫療器械:獲準注冊或者生產的品種涉及《國家級目錄》或《市級目錄》所列第二類、第三類醫療器械。
同一醫療器械生產企業獲準上市或生產的醫療器械產品涉及多種情形的,按照最高情形進行劃分。
第六條 根據本市醫療器械生產企業年度綜合風險信用評定情況(評定指標詳見附件,市藥品監管局可結合監管實際適時調整評定指標),將企業劃分為A、B、C、D四個等級。
(一)A級企業表明其生產質量管理體系運行狀況及監管信用記錄好;
(二)B級企業表明其生產質量管理體系運行狀況及監管信用記錄較好;
(三)C級企業表明其生產質量管理體系運行狀況及監管信用記錄較差;
(四)因出現重大質量安全事件或者嚴重違反法律法規被責令停產停業,或者受到吊銷醫療器械生產許可證行政處罰的企業為D級企業,表明其質量管理體系運行狀況及監管信用記錄差。
第七條 根據本市醫療器械生產企業獲準上市以及生產的醫療器械情形、企業年度綜合風險信用等級,監管級別劃分為以下類別。
第三章 日常檢查頻次的確定
第八條 監管級別為4A、4B、4C的企業,原則上每年至少組織一次全項目檢查。
第九條 監管級別為3A的企業,原則上每兩年全項目檢查不少于一次;監管級別為3B、3C的企業,原則上每年檢查不少于一次且每兩年全項目檢查不少于一次。
第十條 監管級別為2A、2B、2C的企業,原則上每兩年檢查不少于一次。
第十一條 監管級別為1A、1B、1C的企業,每年隨機抽取本行政區域25%以上的企業進行監督檢查。對于首次完成第一類醫療器械生產備案的企業,監管部門應當在企業完成生產備案之日起3個月內開展全項目現場檢查。對于變更生產地址或者增加生產范圍的第一類醫療器械生產企業,相關監管部門必要時可對其進行現場核查。
第十二條 對于年度綜合風險信用等級為D的企業,如屬于被責令停產停業,監管部門應當持續跟蹤企業整改情況,并在企業提出復產申請后開展全項目檢查;通過檢查的企業方可恢復生產,并在下一年度至少組織一次全項目檢查。
第十三條 市藥品監管局根據上級監管要求和監管形勢需要,每年確定重點監管情形(包括重點監管企業類型、重點監管品種),有重點監管情形的相關企業原則上不減少日常檢查頻次。
對于監管級別為4A且無重點監管情形的企業,可酌情減少日常檢查頻次,每兩年全項目檢查不少于一次。
對于監管級別為3A且無重點監管情形的企業,可酌情減少日常檢查頻次,每三年全項目檢查不少于一次。
對于監管級別為2A或2B且無重點監管情形的企業,可酌情減少日常檢查頻次,每三年檢查不少于一次。
第十四條 對于因未參加上一年度綜合風險信用評定而無法確定監管級別的本市醫療器械生產企業,依照《國家藥監局綜合司關于加強醫療器械生產經營分級監管工作的指導意見》,明確相應監督檢查形式、日常檢查頻次和覆蓋率要求。
第四章 日常檢查頻次的調整
第十五條 對于當年存在以下任何一種情形的本市醫療器械生產企業,各級監管部門可酌情在下一年度增加日常檢查頻次:
(一)發生特別重大或重大醫療器械安全突發事件;
(二)責令停產;
(三)責令召回;
(四)涉及醫療器械安全有效性的監督抽檢不合格;
(五)未對醫療器械不良事件(死亡或嚴重)采取有效控制措施;
(六)新增列入《國家級目錄》或《市級目錄》的醫療器械;
(七)新增國家集中帶量采購中選醫療器械;
(八)新增創新醫療器械;
(九)存在較多舉報辦件且已查實存在違法違規行為;
(十)發生負面輿情;
(十一)屬于不具備生產能力的醫療器械注冊人,且經監督檢查發現涉嫌違法違規行為、存在嚴重缺陷,無法較好履行主體責任;
(十二)屬于僅受托生產醫療器械的企業,且經監督檢查發現涉嫌違法違規行為、存在嚴重缺陷,質量管理體系運行狀況較差;
(十三)連續兩年及以上綜合風險信用等級為C級、D級;
(十四)其他可以增加日常檢查頻次的情況。
第十六條 對于連續兩年綜合風險信用等級保持A級的本市醫療器械生產企業,經討論決定可在下一年度減少日常檢查頻次。
第十七條 發生傳染病、流行病暴發等重大應急事件時,對于涉及應急使用醫療器械的本市生產企業,可臨時調整其日常檢查頻次,并按要求加強監管。
第五章 檢查工作要求
第十八條 各級監管部門應當按照年度監管計劃,綜合運用多種形式的檢查強化監督管理,在檢查結束并完成檢查結果判定后5個工作日內,將檢查情況錄入檢查系統,涉及重大問題的,及時處置并報告。
對本市醫療器械生產企業開展的全項目檢查,是指按照醫療器械生產質量管理規范及相應附錄,對監管對象開展覆蓋全部適用項目的檢查,可包括對受托生產企業相應生產活動的檢查。
第十九條 結合落實本市藥品監管部門規范涉企行政檢查有關要求,對于同時生產第一類醫療器械的第二類、第三類醫療器械生產企業,各級監管部門可以合并檢查的,原則上應當合并實施檢查任務。
第二十條 各級監管部門可自行組織、聯合或委托受托生產企業所在地藥品監督管理部門,對外省受托企業相應生產活動開展檢查,相關檢查情況應當及時錄入檢查系統的“外省受托生產企業檢查信息錄入”模塊。
第二十一條 各級監管部門在開展監督檢查過程中,應當督促企業做好產品品種報告、年度自查報告、管理者代表報備、生產條件變化報告、停產后復產情況報告相關工作,并根據檢查情況以及品種報告等情況,及時更新企業生產類型、企業狀態等信息。
第二十二條 本實施細則未盡事宜,按照國家藥品監督管理局相關規定執行。
第二十三條 本實施細則自2025年8月21日起實施,有效期5年,至2030年8月20日止。
以上僅對《實施細則》正文內容進行轉載,如需查看正文中提到的附件,請添加文末小編微信或點擊“閱讀原文”。
信息來源:上海市藥監局
排版整理:金飛鷹藥械
? 未經審查發布醫療器械&處方藥廣告,廣州一公司被罰42萬!
醫療器械注冊咨詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139